We kennen het allemaal: De roodbruine, korrelige laag die ontstaat op ijzeren oppervlakken na blootstelling aan lucht of water. Roest is zo oud als de ontdekking van het ijzer in de prehistorie. Maar wat is roest eigenlijk? Kan je het voorkomen? Hoe moet je roest verwijderen? In dit artikel beantwoorden we al je vragen over roest!
Roest is een fenomeen dat we zien bij ijzer (chemisch element Fe) en ijzerlegeringen zoals staal. Eigenlijk is het niet meer dan een chemische verbinding tussen de ijzeratomen in het metaal en zuurstof atomen (chemisch element O) uit de omgeving. De zuurstof kan uit de lucht komen, die vol zuurstof zit, maar kan ook uit water komen waarin ook veel zuurstof zit. Er zijn zelfs andere omgevingen die nog makkelijker zuurstof afgeven en daardoor tot een veel snellere roestvorming leiden, bijvoorbeeld zuurstofwater. Het resultaat is dat een nieuwe molecule wordt gevormd: ijzeroxide (chemische beschrijving Fe²O³). Om heel precies te zijn is er nog een verschil tussen puur ijzeroxide en roest, wat eigenlijk gehydrateerde ijzeroxide is, maar daar maken hier gemakkelijkheidshalve geen verschil in.
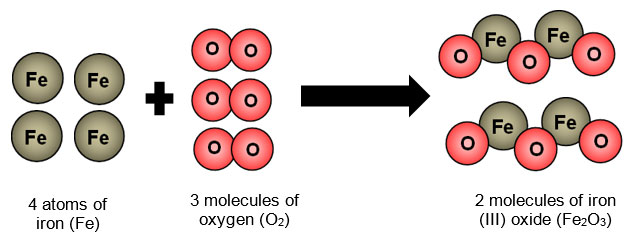
De verbinding tussen een materiaal en zuurstof noemen we een oxidatie reactie, waarin je ook het Engelse woord voor zuurstof, oxygen, terugvindt. Als je iets verbrandt in een vuur maak je ook een verbinding tussen bijvoorbeeld hout en zuurstof, alleen zie je direct dat dit een totaal ander soort oxidatie is. Het verschil is dat er bij roest een oxide-laag wordt gevormd aan de oppervlakte in plaats van doorheen het materiaal en dat deze reactie ook veel trager verloopt dan bij een klassieke verbranding. Vuur is dus een snelle oxidatie, terwijl roest een trage oxidatie is.
De meest mensen hebben al gemerkt dat water, regen of vochtige lucht de vorming van roest nog versnelt. Maar hoe komt dit? Als je het chemisch bekijkt (of onder een heel sterke microscoop), dan zou je zien dat er bij de verbinding tussen ijzeratomen en zuurstofatomen een transport plaatsvindt van elektronen en ionen. Dit zijn “stukjes” van atomen en moleculen (geladen deeltjes) die zich van en naar de ijzermoleculen moeten verplaatsen om de verbinding tot stand te brengen. Roestvorming wordt daarom ook omschreven als een elektrochemisch proces, omdat het transport van vrije elektronen eigenlijk net hetzelfde is als elektriciteit die door een draad stroomt.
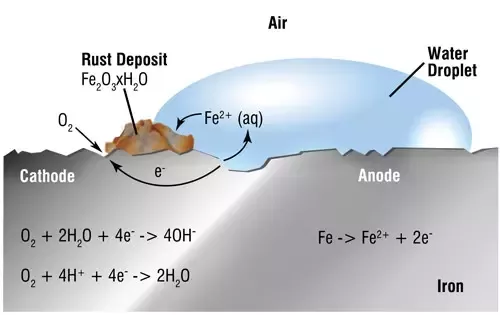
Water werkt een beetje als een autoweg voor deze rondreizende deeltjes. Bepaalde elementen in het water, zoals zout, kunnen dit transport nog verder vergemakkelijken. Daarom zal zeewater nog sneller tot roest leiden. Omgekeerd kan je dus ook concluderen dat gedemineraliseerd water veel minder tot roest zal leiden, omdat er geen deeltjes in aanwezig zijn die het transport van de geladen deeltjes helpen.
Niet helemaal. Er zijn heel wat vormen van corrosie en roestvorming is er eentje van. Corrosie is eigenlijk een overkoepelend begrip dat slaat op het fenomeen waarbij een materiaal chemisch reageert met zijn omgeving en daar in meer of mindere mate schade van ondervindt. Je zal dus ook corrosie hebben in chemische leidingen waar een chemische stof met de leiding reageert. In de industrie is corrosie een groot probleem en ingenieurs steken heel wat tijd in het uitzoeken van de juiste materialen om zo weinig mogelijk last te hebbenvan corrosie. Bekende voorbeelden van corrosie zijn het groen worden van koper en witte vlekken op aluminium.

Roestvorming is het gevolg van een chemische reactie die een oxidelaag vormt. Net zoals bij andere chemische reacties zijn er ook bij oxidatie een aantal parameters die een effect hebben op de snelheid van de reactie. We zetten ze even op een rijtje.

Eerder zeiden we al dat roest gehydrateerd ijzeroxide is. Eén van de eigenschappen van deze stof is dat ze water- en luchtdoorlatend is. Dat betekent dus dat een roestlaag geen beschermingslaag vormt zoals sommige mensen denken. Het roesten blijft dus gewoon doorgaan onder de oppervlakte tot uiteindelijk het hele stuk ijzer is omgezet in ijzeroxide.
Maar waarom is dit zo’n groot probleem?

Dit is een probleem omdat ijzeroxide helemaal niet dezelfde eigenschappen heeft als ijzer, of ijzerlegeringen. Dit materiaal is zeer bros en helemaal niet sterk. Dat heb je zelf zeker al gemerkt: je kan een roestlaag gewoon met de hand losduwen en in een een volledig doorgeroeste plaat of buis kan je gewoon een gat prikken met je vinger. Als je dan weet dat ijzer en staal de basis sterke geven aan heel wat metalen en betonnen constructies (in de vorm van wapeningsijzers), dan begrijp je dat roestvorming kan leiden tot het instorten van een brug, en gebouw of het zinken van een schip.

Gelukkig is roestvorming (meestal) een traag proces en heb je dus jaren de tijd om in te grijpen. Maar het wordt erg gevaarlijk als de roestvorming onzichtbaar is. Je denkt dat je constructie in perfecte gezondheid is, maar onder de oppervlakte loopt het helemaal fout. Dit kan in een betonconstructie zijn, maar evengoed onder een verflaag die er nog redelijk goed uitziet, maar eigenlijk een verroest oppervlakte verbergt.
Als je een beter begrip wilt krijgen in het ontstaan van roest en welke factoren dit proces kunnen versnellen, lees dan eerst ons artikel over roestvorming. Maar wat zijn nu de maatregelen die je kan nemen in het voorkomen van roestvorming?
Heb je uiteindelijk toch last van roest, dan kan je roest zeer eenvoudig verwijderen met laser cleaning. Zo krijg je opnieuw een perfect zuiver metaaloppervlakte die je vervolgens kan behandelen zodat deze niet meer zal roesten.
Interesse? Meer informatie? Een demonstratie? Een offerte ?
Vragen ? Neem contact met ons op.
Interesse in laser cleaning? Vraag via onderstaande knop je gratis proefbewerking aan om alle voordelen van laser cleaning zelf te kunnen ervaren.